第十一章 專利權期間延長
對於醫藥品、農藥品或其製造方法發明專利權之實施,依其他法律規定,應取得許可證者,其於專利案公告後取得時,專利權人得以第一次許可證申請延長專利權期間。本章係就專利權期間延長相關申請規定及其審查事項予以說明。
1.前言
醫藥品、農藥品或其製造方法發明專利為取得確保安全性及有效性等為目的之上市許可證,致未能於專利案公告之日起實施發明專利權者,專利權人得提出專利權期間延長之申請,延長期間以五年為限。
本法所稱「依其他法律規定,應取得許可證者」,於醫藥品係指依藥事法第39條規定,藥品應申請中央衛生主管機關查驗登記,經核准發給藥品許可證後,始得製造或輸入、或依罕見疾病防治及藥物法第14條規定,除本法另有規定外,罕見疾病藥物非經中央主管機關查驗登記,並發給藥物許可證,不得製造或輸入而言;於農藥品係指依農藥管理法第9條規定,農藥應經中央主管機關核准登記,並發給許可證,始得製造、加工或輸入而言。
可申請專利權期間延長之醫藥品,限於增進人類健康與福祉之醫藥品,不包括動物用藥品。
本章所稱之「中央目的事業主管機關」,於醫藥品為衛生福利部,於農藥品為農業部。
於本章中,申請專利權期間延長或申請延長專利權期間,均簡稱申請延長;衛生福利部簡稱衛福部。
2.申請延長之要件
2.1申請延長之發明專利種類
依藥事法第39條、罕見疾病防治及藥物法第14條及農藥管理法第9條之規定,凡取得醫藥品、農藥品或其製造方法發明專利之專利權人,欲實施其專利權時,須先取得中央目的事業主管機關核發之許可證。因此,得申請延長之發明專利僅限於醫藥品、農藥品或其製造方法之發明專利。有關發明專利是否屬於醫藥品之認定,原則上應參照藥事法之相關規定。例如藥事法第6條所定義之藥品,包括使用於診斷、治療、減輕或預防人類疾病之藥品、其他足以影響人類身體結構及生理機能之藥品等。非屬醫藥品、農藥品或其製造方法之發明專利,例如醫療器材、化粧品、健康食品、醫藥品或農藥品之包裝、與製造醫藥品或農藥品有關之中間體或催化劑、製藥機具或裝置、醫藥及農藥用途以外之化學品及其使用等發明專利,均不得申請延長。
本身非屬有效成分之增效劑或輔助活性劑,縱使該增效劑或輔助活性劑屬醫藥品或農藥品或其製造方法之發明專利,亦非屬得申請延長之發明專利種類。
新型專利或設計專利,雖涉及醫藥品或農藥品者,亦不得申請延長。
2.2申請延長之申請人
申請延長之申請人(以下簡稱申請人),限於專利權人。專利權人專屬授權他人實施時,專屬被授權人亦得為申請人。
專利權為共有時,申請延長,除契約約定有代表者外,各共有人皆可單獨為之。
2.3第一次許可證
2.3.1第一次許可證之持有人
第一次許可證之持有人可以是專利權人、專屬或非專屬被授權人。
第一次許可證之持有人與專利權人形式上不一致時,應由申請人提出二者具有同一法人格或有專屬或非專屬授權關係存在之證明。又該等授權不以辦理授權登記為限,惟申請人應檢送延長申請時已完成授權事實之證明文件,未檢送該證明文件或檢送該證明文件仍不齊備者,應駁回延長申請。
若第一次藥品許可證之持有人為非專屬被授權人之再被授權人,則申請人須提供文件證明下列關係:(1)非專屬被授權人與再被授權人間之授權關係;及(2)非專屬被授權人具有再授權他人實施之權利。
2.3.2第一次許可證之認定
據以申請延長的許可證,應為醫藥品、農藥品或其製造方法發明專利權之實施,依相關法律規定所取得之第一次許可證。所稱「第一次許可證」係指就同一有效成分(active ingredient)及同一用途所取得之最初許可。例如相同有效成分及用途之藥品,先後取得兩張以上之許可證者,其最先取得之許可證方為「第一次許可證」。
前述「有效成分」,於醫藥品係根據藥品許可證之「處方」欄所載之有效成分為準;於農藥品係根據農藥許可證之「有效成分種類及其含量」欄所載之有效成分為準。原則上,同一化學部分(chemical moiety)之不同鹽類、不同酯類或不同水合物所取得之不同許可證,均得認定為第一次許可證。例如據以申請延長之發明專利案的申請專利範圍為「化合物A及其鹽類」,若申請人針對同一用途,分別以化合物A的甲酸鹽、化合物A的雙磷酸鹽先後取得不同許可者,則該先後取得之不同許可均得認定為第一次許可證,申請人可選擇其中一件許可,據以申請該發明專利案之延長。
前述「用途」,於醫藥品係根據藥品許可證之「適應症」欄所載之內容為準;於農藥品係根據農藥許可證之「使用方法及其範圍」欄所載之內容為準。
原料藥、農藥原體所取得之許可證,因原料藥、農藥原體係用以製造醫藥品、農藥品之原料,非用於醫藥、農藥用途,故其取得之許可證不屬於本法所稱之「第一次許可證」。
我國中央目的事業主管機關就同一有效成分申請登記後,因新增用途、新劑型、新使用劑量、新單位含量製劑等,可能以另發許可證或於同一張許可證加註變更事項之方式核發多次許可。因此,有關第一次許可證之判斷,進一步說明如下:
(1)就同一有效成分之不同用途取得多數許可之情形:
(i)有關醫藥品,原則上,同一有效成分針對不同用途所取得之每一件許可均得作為申請延長之第一次許可證。若新增用途許可之登記係於同一有效成分之許可證上加註變更事項者,例如劑型、劑量及有效成分相同,僅用途不同,申請人須於申請書載明據以延長之該次用途許可。須注意者,於同一藥品許可證上加註變更事項,若於原核定之適應症外,准予增列新適應症者,則該次許可係為同一有效成分之不同用途許可,屬第一次許可證。例如以干擾素為有效成分,適應症為卡波西氏肉瘤之藥品許可證,其加註變更事項記載「適應症變更,增加:對活性慢性B型肝炎有效」,即表示除卡波西氏肉瘤之適應症外,新增治療活性慢性B型肝炎之適應症,該變更適應症之許可屬第一次許可證。
(ii)有關農藥品,對於農藥品因擴大使用範圍(新增適用作物或新增防治對象等)而核發之多次許可,如係基於同一作用性質者(例如均作為殺菌劑、均作為殺蟲劑、或均作為除草劑等),仍應認定最初核發之許可為第一次許可證。例如,先取得之許可為有效成分A用於防治甘藍菜之紋白蝶,後續取得之許可為有效成分A用於防治甘藍菜之蚜蟲(新增防治對象),由於兩許可之用途均係防治害蟲,屬同一作用性質,則以有效成分A防治甘藍菜蚜蟲之後續許可非屬第一次許可證。又例如,先取得之許可為有效成分B用於防治葡萄之白粉病,後續取得之許可為有效成分B用於防治木瓜之白粉病(新增適用作物),由於兩許可之用途均係防治白粉病,仍係基於同一作用性質,則以有效成分B防治木瓜之白粉病之後續許可,非屬第一次許可證。又例如,先取得之許可為有效成分C用於防治水稻之白葉枯病,後續取得之許可為有效成分C用於防治禾本科作物之細菌性條斑病(新增適用作物及防治對象),雖兩許可之防治對象不同,但由於兩許可之用途均係作為殺菌劑,仍係基於同一作用性質,則以有效成分C防治禾本科作物之細菌性條斑病之後續許可,非屬第一次許可證。
(2)就同一有效成分及同一用途取得多數許可之情形:
(i)第一次許可證係指就同一有效成分及同一用途所取得之最初許可,其後續就同一有效成分及同一用途而針對不同劑型、不同使用劑量、不同單位含量等取得之許可,均非屬第一次許可證。
(ii)先後取得之許可中,新增用途許可之登記係於同一有效成分之許可證上加註變更事項者,若因適應症名稱變更(例如衛福部公告含diclofenac成分藥品,眼藥水劑型之適應症統一修訂為「白內障手術後之眼部發炎」)或因新增適應症與先前適應症有相關者,而導致變更後之適應症取代原核定之適應症,於此種情形下,該變更適應症之許可非屬第一次許可證。
2.4申請延長之法定期間
申請延長應於取得第一次許可證後三個月內向專利專責機關提出,但在專利權期間屆滿前六個月內,不得為之。
由於許可證核發之日期,與專利權人或被授權人實際領取許可證之日期,未必是同一日。因此,取得第一次許可證之日,係以專利權人或被授權人實際領證之日期為準。以變更用途(指藥品之新增適應症或農藥之擴大使用範圍)申請登記,而於核准許可後於原許可證加註變更事項者,其實際領證日期,係指實際領取加註變更事項後之原許可證之日期。
若申請人無法提出實際領證日期之證明,則取得第一次許可證之日以許可證所載之核發日期為準;以變更用途申請登記者,以許可證所載該變更事項之核准日期為準。
2.5申請延長之次數
專利權期間延長制度之立法目的係補足醫藥品、農藥品或其製法發明專利須經法定審查取得上市許可證,而無法實施發明專利之期間,故一件發明專利案,專利權人得申請延長之次數僅限一次。若一發明專利案經核准延長專利權期間,即不得就同一專利案再次核准延長。例如,一發明專利案之專利權範圍包含一有效成分A及其作為殺菌及殺蟲用途,若先以有效成分A作為殺菌劑之農藥許可證申請延長並經核准,嗣後,即不得再以有效成分A作為殺蟲劑之農藥許可證,申請同一專利案之延長。若同時以殺菌劑之許可及殺蟲劑之許可申請同一專利案之延長,專利權人僅得選擇其中一件許可申請延長。
此外,專利權人就第一次許可證僅得申請延長一次,若第一次許可證曾經據以申請延長,專利權人不得再次以同一許可申請延長同一案或其他案之專利權期間。因此,專利權人於取得第一次許可證後,若該許可證同時可對應於多件發明專利案之申請專利範圍時,僅能選擇其中一件發明專利案申請延長。
3.延長申請案之申請
申請延長者,應備具申請書,並檢附依法取得之許可證影本及申請許可之國內外證明文件,向專利專責機關提出。
3.1申請書之記載
申請延長之申請書須載明專利證書號數、發明名稱、專利權人、申請延長之理由、期間及取得第一次許可證之日期等。以下就申請書應記載的相關事項加以說明。
3.1.1發明專利權之存續狀態
申請書應載明專利證書號數、公告日期、專利權期間屆滿日及專利權存續狀態(例如應記載至延長案申請時已繳納專利年費之情形)。
3.1.2第一次許可證事項之說明
為取得第一次許可證而無法實施發明之歷程及其期間,為申請延長之主要依據,申請人應詳實記載。有關第一次許可證事項之說明,應包括下列事項:
(1)依法獲准的許可證所依據之法律
醫藥品係依藥事法第39條、罕見疾病防治及藥物法第14條之規定,應獲准許可證方可實施其專利權;農藥品係依農藥管理法第9條之規定,應獲准許可證方可實施其專利權。
(2)第一次許可證所記載之特定許可事項
申請延長之理由應記載第一次許可證之內容,包含許可的有效成分及其用途。於醫藥品,通常係轉載藥品許可證之「處方」欄所載之有效成分及「適應症」欄所載內容;於農藥品,通常係轉載農藥許可證之有效成分及「使用方法及其範圍」欄所載內容。
(3)第一次許可證之有效成分及其用途與申請專利範圍之關連性
申請延長之醫藥品、農藥品或其製造方法發明專利,其申請專利範圍須涵蓋據以申請延長之第一次許可證所載之有效成分及用途。因此,申請書須說明第一次許可證記載之有效成分及用途與申請專利範圍之關連性。須注意者,第一次許可證所載有效成分及用途之表現形式與請求項內容不一致者,申請人須詳細說明兩者之關係,若專利說明書中有兩者關係之記載時,應指明該記載部分。例如,當請求項為以化學式或化學名稱表示請求之化合物,而許可證記載之有效成分係以藥典記載之名稱、學名、通俗名稱表示時,申請人除須提出藥典記載之依據,明確說明該有效成分之化學式或化學名稱,及其與請求項化合物之關係外,若專利說明書中有關於以化學式或化學名稱表示之化合物即為藥典記載之名稱、學名、通俗名稱之記載時,須指明於專利說明書中之記載部分。又如,請求項所述醫藥用途係以藥理機制界定,而許可證所記載之適應症為特定病症名稱時,申請人須說明該藥理機制與該特定病症之關係,若專利說明書中有兩者關係之記載者,應指明該記載部分。
3.1.3為取得許可證而無法實施發明之歷程及其期間
申請延長之理由須記載為取得許可證而無法實施發明之歷程,亦即與取得許可有關之各主要事實及其期間。
3.1.3.1為取得許可證而無法實施發明之歷程
有關為取得許可證而無法實施發明之歷程,於醫藥品,須記載為取得衛福部核發藥品許可證,所進行之國內外臨床試驗計畫與其起、訖日期,及國內申請藥品查驗登記之審查歷程與相關期間;於農藥品,須記載為取得農業部核發農藥許可證,所進行之國內外田間試驗計畫與其起、訖日期,及國內申請農藥登記之審查歷程與相關期間。前述各期間之記載說明如下。
3.1.3.1.1醫藥品之國內外臨床試驗期間
(1)國內臨床試驗期間
醫藥品之國內臨床試驗期間之起日,係指衛福部同意申請人進行國內臨床試驗(含銜接性試驗)計畫時所發給同意試驗進行函之日期。醫藥品之國內臨床試驗期間之訖日,係指衛福部同意備查該臨床試驗(含銜接性試驗)報告時所發給之同意報告備查函之日期。前述銜接性試驗須為經衛福部評估應執行者。若以相同有效成分進行不同之臨床試驗時,應記載衛福部分別同意進行各試驗之日期及分別同意備查各臨床試驗報告之同意函日期,作為其各自試驗期間之起、訖日。
(2)國外臨床試驗期間
以國外臨床試驗期間申請延長者,應說明國外臨床試驗計畫之重點,例如試驗計畫名稱、計畫編號、試驗藥品、試驗階段等,並記載符合ICH(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use)規範之臨床試驗報告書所定義之試驗開始日期(study initiation date)及試驗完成日期(study completion date),作為國外臨床試驗期間之起、訖日。
3.1.3.1.2國內申請藥品查驗登記審查期間
國內申請藥品查驗登記審查期間,以向衛福部申請查驗登記之日期(以衛福部收件日期為準)為起日,以實際領證日期(通常為藥品仿單標籤黏貼表所記載之日期)為訖日。
3.1.3.1.3農藥品之國內外田間試驗期間
農藥品之國內田間試驗期間原則上起日係指農業部認可之機關(構)、學校、法人或團體開始進行農藥田間試驗之日期;訖日則為完成田間試驗之日期,亦即田間試驗報告書所記載之試驗開始日及試驗完成日
由於農業部對於農藥登記之審查,其書面審查之資料包括國外田間試驗資料,因此,以國外田間試驗期間申請延長者,應說明該國外田間試驗計畫之重點,例如試驗計畫名稱、計畫編號、農藥名稱、農藥使用範圍等,並記載該田間試驗開始進行及試驗完成之日期,作為國外田間試驗期間之起、訖日。
3.1.3.1.4國內申請農藥登記審查期間
國內申請農藥登記審查期間之起日為申請人檢具相關登記資料,經農業部農藥登記收件之日期;訖日為農藥許可證上所記載之發證日期。
3.1.3.2為取得許可證而無法實施發明期間之計算
為取得許可證而無法實施發明之期間,為依本章3.1.3「為取得許可證而無法實施發明之歷程及其期間」中所載各國內外試驗期間(其中國內外試驗開始日在專利案公告日之前者,自公告日起算;國內外試驗開始日在專利案公告日之後者,自該試驗開始日起算)及國內申請許可證審查期間(計算至實際領證日之前一日),將其加總後,扣除國內外試驗重疊期間及試驗與許可證審查重疊期間,計算而得(以「日」為單位),即使超過5年以上者,仍依計算所得之實際無法實施期間予以記載。
3.1.4申請延長期間之記載
為取得許可證而無法實施發明之期間不足5年而申請延長者,申請延長之期間應以「日」為單位,記載「本案申請延長專利權期間○日」;超過5年者,申請延長之期間以5年為限,應記載「本案申請延長專利權期間5年」。
3.2檢附資料
申請延長專利權期間者,應檢附依法取得之許可證影本及申請許可之國內外證明文件,分述如下。
3.2.1醫藥品或其製造方法
申請延長之專利權為醫藥品或其製造方法者,除藥品許可證影本外,並應檢附下列文件:
(1)國內臨床試驗期間(含銜接性試驗期間)、國外臨床試驗期間與起、訖日期之證明文件及清單。所述清單應表列各項臨床試驗計畫之名稱、計畫編號及其起、訖日期等。(醫藥品臨床試驗清單範例參見附錄)
(2)國內申請藥品查驗登記審查期間及其起、訖日期之證明文件。
前述國內臨床試驗(含銜接性試驗)期間起、訖日期之證明文件,係指經衛福部發給之同意試驗進行函,以及嗣後同意備查臨床試驗報告(含銜接性試驗報告)之同意報告備查函。以銜接性試驗期間申請延長者,應另檢附向衛福部申請銜接性試驗評估及評估結果之相關文件。
國外臨床試驗期間起、訖日期之證明文件,為國外進行該臨床試驗之試驗單位或機構等出具之證明文件,例如提供記載有試驗計畫名稱、計畫編號、試驗藥品、臨床試驗階段、試驗單位及試驗開始日及試驗完成日等之試驗報告書之摘頁影本。
國內申請藥品查驗登記審查期間起日之證明文件,應為足以證明申請查驗登記日期之官方文件,例如載有衛福部收件日期之通知函;至於訖日之證明文件,通常為藥品仿單標籤黏貼表影本。
由於醫藥品中央目的事業主管機關業將核發藥品許可證所需之國內外臨床試驗之審核,納入「資料專屬期及國內外臨床試驗資料表」,就申請人所檢送之國內外臨床試驗資料,予以審核確認,如有修正,並於該資料表上註明其認定結果,且蓋以機關之騎縫章為確認,是以申請人若檢送蓋有騎縫章之「資料專屬期及國內外臨床試驗資料表」作為國內外臨床試驗期間之證明文件,則有關由醫藥品中央目的事業主管機關確認為取得核發藥品許可證所需進行之國內外臨床試驗,得逕以該資料表為判斷依據。
3.2.2農藥品或其製造方法
申請延長之專利案為農藥品或其製造方法者,除農藥許可證影本外,並應檢附下列文件:
(1)國內外田間試驗期間與起、訖日期之證明文件及清單。所述清單應表列各項田間試驗計畫之名稱、計畫編號及其起、訖日期等。(農藥品田間試驗清單範例參見附錄)
(2)國內申請農藥登記審查期間及其起、訖日期之證明文件。
國內申請農藥登記審查期間起日之證明文件,為足以證明申請人業經農業部農藥登記完成收件之官方文件,例如載有收件日期之申請許可登記申請書影本。至於訖日之證明文件,通常為載有發證日期之農藥許可證影本。
3.3申請書記載之範例(以醫藥品為例)
|
一、發明專利之有效性 |
|
|
申請日 公告日 專利權期間屆滿日 專利年費有效日期 |
○年○月○日 ○年○月○日 ○年○月○日 |
|
二、許可證事項之說明 |
|
|
(一)依法獲准的許可證所依據之法律 醫藥品係依藥事法第39條之規定,應獲准許可證方可實施其專利權。 |
|
|
(二)許可證字號:○○○ |
|
|
(三)許可證持有人與專利權人之關係:同一人 |
|
|
(四)許可證記載之特定許可事項 有效成分:○○○ 適應症:○○○ |
|
|
(五)許可證之有效成分(或有效成分及其用途)與申請專利範圍之關連性 依法獲准許可之有效成分屬於請求項1中之「式(I)化合物,其中R1為氫原子」者之範圍。 |
|
|
三、申請延長之理由 |
|
|
(一) 為取得許可證而無法實施發明專利權期間之事實說明:(略) (二) 為取得許可證而無法實施發明專利權期間之歷程: A.國內外臨床試驗期間 B.查驗登記審查期間 (三) 為取得許可證而無法實施發明之期間:合計○日 |
|
|
四、申請延長之期間:本案申請延長專利權期間○日 |
|
|
五、取得第一次許可證之日期:○年○月○日 |
|
|
六、檢附資料 A.專利公報○年○月○日發明第○○○號公告影本 B.○○○字第○○○號許可證影本 C.藥品仿單標籤黏貼表影本 D.銜接性試驗期間及其起、訖日期之證明文件影本1份 E.申請銜接性試驗評估及評估結果之證明文件影本1份 F.國外臨床試驗期間起、訖日期之證明文件影本1份 G.國內外臨床試驗清單一式2份(註明檢送之臨床試驗於查驗登記送審資料出處,例如:「送審光碟第O片第O頁」、「送審資料第O本第O頁」) |
|
3.4申請延長之公告
受理申請延長時,為利公眾知悉專利權期間延長申請案之狀態,應將申請書之內容公告之。
4.延長申請案之審查
有關延長申請案之審查,除須審查申請人、發明專利案是否符合申請延長要件外,尚須依申請延長之理由所述之內容,並參照檢附之證明文件,予以確認及判斷有關期間採計與否。由於採計國內外臨床試驗期間(醫藥品)或田間試驗期間(農藥品),以經中央目的事業主管機關確認其為核發許可證所需者為限,故審查時,應先將申請人所檢附之表列有各項試驗之清單,送請中央目的事業主管機關確認之,並嗣中央目的事業主管機關函復結果後,續行審查。若申請人檢附蓋有中央目的事業主管機關騎縫章之「資料專屬期及國內外臨床試驗資料表」作為國內外臨床試驗期間之證明文件者,無須送請中央目的事業主管機關確認,可依該資料表逕行審查。惟如非屬前述經衛福部審核確認之「資料專屬期及國內外臨床試驗資料表」,或依該「資料專屬期及國內外臨床試驗資料表」審認之內容,認有疑義者,可函送衛福部予以確認。以下僅就審查之相關事項與核准延長期間之採認與計算加以說明。
4.1第一次許可證之判斷
判斷據以申請延長之許可證是否屬第一次許可證,應就許可證所載之有效成分及用途進行查證,例如利用中央目的事業主管機關網站之許可證查詢系統進行查詢,必要時,得函請中央目的事業主管機關協助確認。
據以申請延長之許可證非屬第一次許可證,或同一許可曾經據以申請延長其他案之專利權期間者,不得准予延長專利權期間。
4.2第一次許可證之持有人非為申請人之處理
若申請人非為第一次許可證之持有人,則申請人與第一次許可證之持有人應具有授權關係。若第一次許可證之持有人非為申請人,應通知申請人檢送延長申請時已完成授權事實之證明文件,屆期未檢送該證明文件或檢送該證明文件仍不齊備者,應駁回延長申請。
4.3申請專利範圍與第一次許可證之關連性判斷
延長申請案之審查,必須確認第一次許可證所載之有效成分及用途須為該案申請專利範圍所涵蓋。若為物之發明專利,則第一次許可證所載之有效成分須為物之請求項範圍所涵蓋;若為用途發明專利,則第一次許可證所載之有效成分及用途須為用途請求項範圍所涵蓋;若為物之製造方法發明專利,則第一次許可證所載之有效成分須為製法請求項所製得之物的範圍所涵蓋。
有關第一次許可證所載之有效成分及用途與延長申請案之申請專利範圍關連性之判斷,舉例說明如下:
(1)對於物之發明專利案,申請專利範圍中至少一個請求項內容須涵蓋許可證所載有效成分。
例1.
申請延長之專利案
請求項1:一種化合物A。
請求項2:如請求項1之化合物A,其為化合物a。(a為化合物A之範圍所涵蓋)
第一次許可證
處方:化合物a之苯磺酸鹽
適應症:止痛
〔說明〕
第一次許可證處方欄所載之有效成分為化合物a之苯磺酸鹽,因請求項1、2皆未記載化合物A之鹽類,故許可證所載之化合物a之苯磺酸鹽無法為請求項1、2之範圍所涵蓋。
例2.
申請延長之專利案
請求項1:一種化合物B及其鹽類。
第一次許可證
處方:化合物b(b為化合物B之範圍所涵蓋)
適應症:與其他抗癌劑合用,以治療乳癌
〔說明〕
第一次許可證處方欄所載之有效成分為化合物b,雖該許可證之適應症欄記載須與其他抗癌劑合用,惟該處方欄僅記載單一有效成分化合物b,故應以化合物b與請求項1之化合物B比對,經判斷化合物b為請求項1之化合物B範圍所涵蓋,應認第一次許可證所載之有效成分為請求項1之範圍所涵蓋。
例3.
申請延長之專利案
請求項1:一種化合物A及其異構物。
請求項2:如請求項1之化合物A及其異構物,其為左型(L-form)
化合物a。
第一次許可證
處方:化合物a之L型異構物
適應症:止痛
[說明]
第一次許可證處方欄所載之有效成分為化合物a之L型異構物,經判斷化合物a之L型異構物為請求項1、2之範圍所涵蓋,應認第一次許可證所載之有效成分為請求項1、2之範圍所涵蓋。
例4.
申請延長之專利案
請求項1:一種化合物A及其藥學上可接受之鹽。
請求項2:如請求項1之化合物A及其藥學上可接受之鹽,該化
合物A為化合物a。
第一次許可證
處方:化合物a之甲酸鹽
適應症:止痛
〔說明〕
第一次許可證處方欄所載之有效成分為化合物a之甲酸鹽,該甲酸鹽為藥學上可接受之鹽,故化合物a之甲酸鹽可為請求項1、2之範圍所涵蓋,應認第一次許可證所載之有效成分為請求項1、2之範圍所涵蓋。
例5.
申請延長之專利案
請求項1:一種化合物C。
請求項2:一種包含化合物C之醫藥組成物。
第一次許可證
處方:化合物c之三水合物(c為化合物C之範圍所涵蓋)
適應症:抗生素
〔說明〕
第一次許可證處方欄所載之有效成分為化合物c之三水合物,惟請求項1、2僅記載化合物C,並未記載化合物C之水合物,故許可證所載化合物c之三水合物無法為請求項1、2之範圍所涵蓋。
例6.
申請延長之專利案
請求項1:一種Ivabradine鹽酸鹽之b-結晶型。
請求項2:一種包含Ivabradine鹽酸鹽b-結晶型之醫藥組成物。
第一次許可證
處方:Ivabradine鹽酸鹽
適應症:治療慢性心衰竭
〔說明〕
第一次許可證處方欄所載之有效成分為「Ivabradine鹽酸鹽」,並非「Ivabradine鹽酸鹽之b-結晶型」,無法為請求項1、2之範圍所涵蓋。
例7.
申請延長之專利案
請求項1:amisulpride。(未界定光學異構性質)
第一次許可證
處方:S(-)amisulpride
適應症:抗焦慮
〔說明〕
請求項1所載之amisulpride未界定光學異構性質,可認定為外消旋型化合物,故第一次許可證所載之S(-)amisulpride無法為請求項1之範圍所涵蓋。
例8.
申請延長之專利案
請求項1:一種抗癌組成物,包含化合物A。
請求項2:如請求項1之抗癌組成物,另包含化合物B。
第一次許可證
處方:化合物a
化合物b
適應症:治療骨癌
〔說明〕
第一次許可證所載之有效成分係化合物a及化合物b之組合,所載之適應症為治療骨癌,由於請求項1之抗癌組成物為開放式寫法,故應認第一次許可證所載之有效成分及用途為請求項1、2之範圍所涵蓋。
例9.
申請延長之專利案
請求項1:一種抗癌組成物,係由化合物A與化合物B所組成。
第一次許可證
處方:化合物a
化合物b
適應症:治療骨癌
〔說明〕
第一次許可證所載之有效成分為化合物a及化合物b,且所載之適應症為治療骨癌,可為請求項1之範圍所涵蓋。
例10.
申請延長之專利案
請求項1:一種抗癌組成物,係由化合物A與化合物B所組成。
第一次許可證
處方:化合物a
化合物b
化合物c
適應症:治療骨癌
〔說明〕
請求項1之抗癌組成物僅由化合物A與B所組成(封閉式寫法),故第一次許可證所載之有效成分係化合物a、化合物b及化合物c之組合並無法為請求項1之範圍所涵蓋。
(2)對於用途請求項之發明專利案,申請專利範圍中至少一個用途請求項之內容須涵蓋第一次許可證所載有效成分之用途,若形式上不同時,例如請求項所述醫藥用途係以藥理機制界定,而許可證所記載之適應症為特定病症名稱,申請人須說明藥理機制與特定病症之關係,若專利說明書中有兩者關係之記載時,應指明該記載部分。
例1.
申請延長之專利案
請求項1:使用化合物D製備抗病毒組成物的用途。
請求項2:如請求項1之用途,其中化合物D為化合物d。
請求項3:如請求項1之用途,其中抗病毒組成物為抗HIV劑。
第一次許可證
處方:化合物d(d為化合物D之範圍所涵蓋)
適應症:抗HIV
〔說明〕
第一次許可證所載之有效成分化合物d,涵蓋於化合物D之範圍內,抗HIV用途為抗病毒之下位概念,應認第一次許可證之有效成分化合物d及抗HIV用途涵蓋於請求項1~3之範圍內。
例2.
申請延長之專利案
請求項1:使用化合物E於製備抗腫瘤藥物的用途。
請求項2:如請求項1之用途,其中化合物E為化合物e。
第一次許可證
處方:化合物e(e為化合物E之範圍所涵蓋)
適應症:治療尿失禁
〔說明〕
第一次許可證所載之有效成分化合物e,雖為請求項1、2所載化合物E之範圍所涵蓋,惟所載治療尿失禁之適應症與請求項1、2之抗腫瘤用途不同,應認第一次許可證之有效成分化合物e於治療尿失禁之用途無法為請求項1、2之範圍所涵蓋。
(3)對於製法之發明專利案,申請專利範圍中至少一個製法請求項所製得之物必須涵蓋許可證所載之有效成分(許可證並無有關製造方法之記載)。許可證所述之有效成分無法直接由請求項表現,或表現方式與請求項內容不一致之情形,申請人須詳細說明兩者之關係,若專利說明書或申請專利範圍中有兩者關係之記載時,應指明該記載部分。
例1.
申請延長之專利案
請求項1:一種化合物A之製造方法
第一次許可證
處方:化合物a(a為化合物A之範圍所涵蓋)
適應症:止痛
〔說明〕
第一次許可證並無記載化合物a之製造方法,故只要判斷第一次許可證所載之有效成分化合物a為化合物A之範圍所涵蓋,即可認第一次許可證與請求項1具有關連性。
4.4准予延長期間之審查與計算
有關准予延長期間之審查,如有據以申請延長之期間因證明文件未完備而無法採計、申請延長之期間計算有誤、或經查有可歸責於申請人之不作為期間未予以扣除等情事,應通知申請人限期申復或補充資料,屆期未申復,或經申復或補充資料後仍無法克服者,逕依現有資料認定准予延長之期間。以下就醫藥品及農藥品得准予延長之期間分別說明之。
4.4.1醫藥品或其製造方法發明專利
醫藥品或其製造方法發明專利,准予延長專利權之期間包含:
(1)為取得衛福部核發藥品許可證所進行之國內外臨床試驗期間(含銜接性試驗期間);及
(2)國內申請藥品查驗登記審查期間。
所述為取得衛福部核發藥品許可證所進行之國內外臨床試驗,以經衛福部確認其為核發藥品許可證所需者為限。
由於為取得衛福部核發許可證所進行之國內臨床試驗期間(含銜接性試驗期間)係以取得衛福部同意執行臨床試驗,及嗣後同意備查臨床試驗報告為其要件,故向衛福部申請銜接性試驗評估之行政作業期間,不予採計。
前述各期間尚應扣除下列期間:
(1)可歸責於申請人之不作為期間;
(2)國內外臨床試驗(含銜接性試驗)重疊期間;及
(3)國內外臨床試驗(含銜接性試驗)與查驗登記審查重疊期間。
前述可歸責於申請人之不作為期間之認定,參見本章4.4.3「可歸責於申請人之不作為期間」。
4.4.2農藥品或其製造方法發明專利
農藥品或其製造方法發明專利,准予延長專利權之期間包含:
(1)為取得農業部核發農藥許可證所進行之國內外田間試驗期間;及
(2)
國內申請農藥登記審查期間。
前述國內外田間試驗,以經專利專責機關送請農業部確認其為核發農藥許可證所需者為限。
前述各期間尚應扣除下列期間:
(1)可歸責於申請人之不作為期間;
(2)國內外田間試驗重疊期間;及
(3)國內外田間試驗與登記審查重疊期間。
前述可歸責於申請人之不作為期間之認定,參見本章4.4.3「可歸責於申請人之不作為期間」
4.4.3可歸責於申請人之不作為期間
所謂「可歸責於申請人之不作為期間」係指申請人怠於盡其應有之注意程度,而發生中斷或延遲取得許可證之期間。於取得許可證之過程中,可歸責於申請人之不作為之情形,舉例說明如下。
(1)藥品查驗登記或農藥登記申請,均已明定應備具之文件及規費,如有因資料不齊備、未繳納規費或衛福部審查時因資料不符取得許可證之標準,而發生須補件或補繳,導致延遲取得許可證期間者,原則上應屬可歸責於申請人之不作為期間。
(2)藥品查驗登記,經審查通過後,衛福部將通知辦理領證,因此,該領證通知函之送達日期應視為衛福部完成許可證審查之日,故自領證通知函送達日之次日起算至實際領證日之前一日止之期間,應屬可歸責於申請人之不作為期間。
(3)農藥登記經農業部審查核准通過後,將依法公告。自公告之日起,農藥登記申請人即具有申請核發農藥許可證之資格,故農藥「使用方法及其範圍」核准公告日至農藥發證日之前一日止之期間,應屬可歸責於申請人之不作為期間。
前述(1)、(2)及(3)之可歸責於申請人之不作為期間,於計算准予延長之期間時,應予以扣除。至於補件期間之計算依據,可通知申請人提供申請許可證案件之申請流程相關資料(例如於中央目的事業主管機關網站之「申請案件狀態查詢」系統查得之申請案件流程記錄),惟審查人員亦可進行查證,或函請中央目的事業主管機關協助提供以其資訊系統所查詢出之審查流程相關資訊。
4.5審查注意事項
(1)以特定化合物之前藥形式(例如該特定化合物之特定酯類)取得特定適應症之藥品許可證,即使先前已有同一特定化合物基於同一適應症取得藥品許可證,仍得認為係第一次許可證,惟該前藥形式應涵蓋於據以申請延長之申請專利範圍內。
(2)專利權人或被授權人若於同日取得相同有效成分及相同用途之多件許可證(例如相同有效成分及相同用途,僅劑量不同,而於同日核發之多次許可),由於專利權人得以第一次許可證申請延長,並以一次為限,且該許可證僅得據以申請延長一次,故申請延長之申請人僅能選擇其中一件許可申請延長。若於申請延長時,申請人同時提出多件同日核發之相同有效成分及相同用途之許可證者,應通知申請人限期於1個月內擇一申請延長,屆期未擇一,依本法第17條規定辦理。
(3)若專利權人或專屬被授權人依據相同有效成分及相同用途之兩件(或兩件以上)發證日期相同之第一次許可證,分別就兩件(或兩件以上)不同發明專利案申請延長,由於第一次許可證僅能被據以延長專利權期間一次,因此應通知專利權人限期1個月內選擇其中之一件許可證申請該案延長。若經通知後仍未選擇,應駁回延長申請。例如,專利權人以A許可證申請甲案之專利權期間延長,以B許可證申請乙案之專利權期間延長,經審查A、B許可證為同一有效成分、同一用途(僅劑量不同)且同日發證之許可證,應通知專利權人限期1個月內選擇甲案(A許可證)或乙案(B許可證)申請延長,若經通知後仍未選擇,應駁回甲、乙案之延長申請。
(4)申請延長之前提在於專利權須為有效存在,惟核准專利權期間延長時,亦須該專利權仍有效存在,始有准予延長之實益。因此,經受理之延長申請案,於審查時,若專利權已當然消滅或遭撤銷確定,或據以延長之許可證所載有效成分及其用途所對應之請求項業經更正刪除或撤銷確定,因申請延長之標的已不存在,延長之申請應予駁回。惟於原專利權期間屆滿時尚未審定之延長申請案,仍應續行審查。
(5)供學術研究用之國內臨床試驗原則上非屬國內臨床試驗期間,但經衛福部同意該國內臨床試驗轉換為查驗登記用之國內臨床試驗,得採計為國內臨床試驗期間,其起日為該學術研究用之國內臨床試驗的開始進行日,而非轉換日。
4.6案例
以下舉例說明專利權期間延長之計算方法。
例1.
國外臨床試驗開始日在專利公告日之前,其起日自公告日起算。

【說明】
由於國外臨床試驗開始日早於專利公告日,則試驗開始日至專利公告日前之期間(X)不計入得核准延長期間,故國外臨床試驗期間應採計自專利公告日起至國外臨床試驗完成日止。(註:E係為取得許可證所需進行之國內外試驗期間及國內許可證之審查期間之總合,扣除可歸責申請人之不作為期間及各期間之重疊期間,以日為單位計算而得;E≧5者,仍以5年為限)
例2.
國外臨床試驗開始日在專利公告日之後,其起日自國外臨床試驗開始日起算。
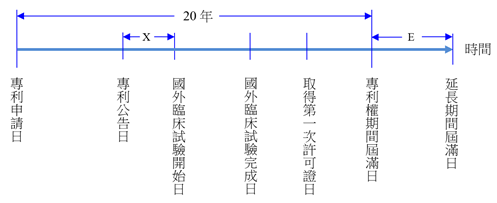
【說明】
由於國外臨床試驗開始日晚於專利公告日,專利公告日至試驗開始日前之期間(X)不計入得核准延長期間(E)。
例3.
申請農藥登記之日在專利公告日之後,至取得第一次許可證之期間超過5年。
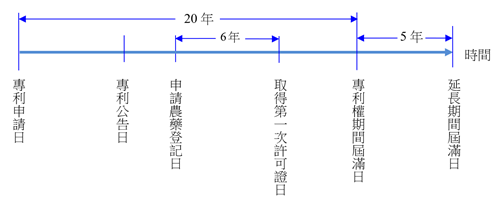
【說明】
由於申請農藥登記之日在專利公告日之後,故取得許可證所需期間應以申請農藥登記之日起算至取得第一次許可證之前一日止之期間,雖然取得許可證所需期間為6年,但仍以5年為限。
例4.
重疊期間及可歸責於申請人之不作為期間扣除之計算方式。
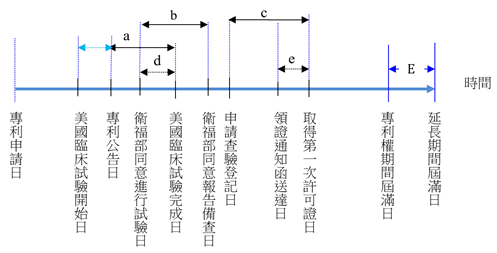
【說明】
以美國試驗期間申請專利權期間延長者,由於美國臨床試驗開始日早於專利公告日,故美國臨床試驗期間採計自專利公告日至美國臨床試驗完成日(a);國內臨床試驗期間係自衛福部同意進行試驗日起算至衛福部同意報告備查日止之期間(b);許可證之審查期間係自申請查驗登記日起算至取得第一次許可證之前一日止之期間(c);可歸責於申請人之不作為期間為自領證通知函送達日之次日起算至取得第一次許可證之前一日止之期間(e)。
准予延長之期間(E)
= 國外臨床試驗期間(a) + 國內臨床試驗期間(b) + 許可證之審查期間(c) - 美國臨床試驗期間與國內臨床試驗期間之重疊期間(d) - 可歸責於申請人之不作為期間(e)(E≧5者,仍以5年為限)
5.延長申請案之審定
專利專責機關對於延長申請案,應指定專利審查人員審查,作成審定書送達專利權人。
5.1核准審定書之記載
經審查得核准延長者,核准延長之期間,不得超過為向中央目的事業主管機關取得許可證而無法實施發明之期間;為取得許可證而無法實施發明之期間超過5年者,其延長期間仍以5年為限。核准延長期間應記載於審定主文,其不足5年者,應以日為單位記載:「本案發明專利權期間准予延長○日,至民國○年○月○日止」;其超過5年者,審定主文之記載為:「本案發明專利權期間准予延長5年,至民國○年○月○日止」。惟須注意者,經審查得採計為取得許可證而無法實施發明之期間超過申請延長之期間者,以所申請延長之期間為限。
延長申請案核准審定書應記載核准延長之標的(物、用途或製法)。撰寫方式,應以適應症在前、有效成分在後,且製法應加入適應症界定。以醫藥品發明為例,核准延長標的為「有效成分」者,寫法為:用於(適應症)之(有效成分);核准延長標的為「用途」者,寫法為:(有效成分)於(適應症)之用途;核准延長標的為「製法」者,寫法為用於(適應症)之(有效成分)之製法。核准延長標的若同時涵蓋物、用途及製法者,倘許可證所載適應症之內容過於冗長,則於第2次述及適應症時,可以簡明方式描述,例如(有效成分)於前述適應症之用途、用於前述適應症之(有效成分)之製法等。
5.2申請延長審定之效果
若於其核准審定前,該專利權期間已屆滿,則其專利權期間擬制自原專利權期間屆滿之次日起視為已延長;若審定結果為不予延長者,該擬制之效果則自始不發生,即專利權期限至原專利權期間屆滿日止。
6.核准延長發明專利權期間之範圍
經核准延長發明專利權期間者,其於延長發明專利權期間之範圍,僅及於許可證所載之有效成分及用途所限定之範圍,不及於申請專利範圍中有記載而許可證未記載之其他物、其他用途或其他製法。具體言之,對於物之發明專利,其延長期間之專利權範圍僅限於第一次許可證所載之有效成分及該許可之用途;於用途發明專利,僅限於第一次許可證所載有效成分之許可用途;於製法發明專利,僅限於製備第一次許可證所載用於許可用途之有效成分之製法。核准延長之專利案,其申請專利範圍同時包含物之請求項、用途請求項及製法請求項者,於延長發明專利權期間之範圍,僅分別及於許可證所載之用於許可用途之有效成分、該有效成分之許可用途及用於許可用途之有效成分之製法。
例1.
原公告之申請專利範圍為一種阿斯匹靈之製法,經以適應症為偏頭痛之阿斯匹靈許可證申請延長專利權期間,其核准延長發明專利權期間之專利權範圍僅限於治療偏頭痛之阿斯匹靈之製法。
例2.
原公告之申請專利範圍為一種阿斯匹靈,經以適應症為偏頭痛之阿斯匹靈許可證申請延長專利權期間,其核准延長發明專利權期間之專利權範圍將僅限於治療偏頭痛之阿斯匹靈。
例3.
原公告之申請專利範圍為一種以化合物A防治雙子葉植物蟲害之用途,經以有效成分為化合物a(a涵蓋於A之範圍內),使用方法及範圍為適用於殺滅蘋果(作物名稱)果蠅類(病蟲名稱)之農藥許可證申請延長專利權期間,其核准延長發明專利權期間之專利權範圍僅限於化合物a於殺滅蘋果果蠅之用途。
7.過渡事項
本法修正前,已提出之延長申請案,於修正施行後尚未審定,且其發明專利權仍存續者,適用修正施行後之規定。所述規定亦包括專利權期間延長核定辦法及專利權期間延長審查基準之規定。
本法修正施行前,已提出之延長申請案,於本法修正施行後方進行審查時,有關申請延長之理由、期間、應檢附之證明文件等,如依修正施行後之規定,有理由不完備、證明文件無法證明為取得許可證而無法實施發明之期間,或證明文件未齊備等情事,應通知申請人申復、補充說明或補提證明文件,遇有疑義者,應函請中央目的事業主管機關協助確認。經通知申請人申復、補正,如申請人逾期未申復、補正或經申復、補正仍無法克服者,依修正施行後之規定予以審定。
8.附錄
8.1醫藥品國內外臨床試驗清單範例
(一)醫藥品國內臨床試驗清單(註:專利公告日前已完成之臨床試驗,無須填列)
|
序號 |
臨床試驗計畫名稱 |
臨床試驗計畫編號 |
衛福部同意試驗進行函之發文日期 |
衛福部同意報告備查函之發文日期 |
試驗藥品(包含品名、成分名、劑型、含量) |
送審資料出處 |
|
1 |
隨機分派, 雙盲,安慰劑為對照組, 且以X為附加治療的試驗, 以評估Y治療第二型糖尿病患者的療效與安全性 |
******** |
○年○月○日 |
○年○月○日 |
X |
送審光碟第○片第○頁 |
|
2 |
多中心、隨機、雙盲、以安慰劑為對照之第三階段臨床研究。評估使用X和Y合併療法用於只接受Y單一療法對血糖控制不良的第二型糖尿病患者的安全性及療效 |
******** |
○年○月○日 |
○年○月○日 |
X |
送審資料第○本第○頁 |
(二)醫藥品國外臨床試驗清單(註:專利公告日前已完成之臨床試驗,無須填列)
|
序號 |
臨床試驗計畫名稱 |
臨床試驗計畫編號 |
臨床試驗開始日 |
臨床試驗完成日 |
試驗藥品(包含品名、成分名、劑型、含量) |
送審資料出處 |
|
1 |
Long-term trial to assess the effective- ness and safety of X patch in early stage parkinson's disease |
******** |
○年○月○日 |
○年○月○日 |
X |
送審光碟第○片第○頁 |
8.2農藥品國內外田間試驗清單範例
|
序號 |
田間試驗計畫名稱 |
田間試驗計畫編號 |
田間試驗開始日 |
田間試驗 完成日 |
|
1 |
39.5%SC扶吉胺於檬果炭疽病 |
99EX****-10 |
○年○月○日 |
○年○月○日 |
|
2 |
39.5%SC扶吉胺於檬果炭疽病 |
99EX****-11 |
○年○月○日 |
○年○月○日 |
|
3 |
39.5%SC扶吉胺於檬果炭疽病 |
99EX****-12 |
○年○月○日 |
○年○月○日 |
(註:專利公告日前已完成之田間試驗,無須填列)